L’interaction entre les lipides et les protéines membranaires est essentielle à de nombreux processus cellulaires fondamentaux tels que la respiration, la photosynthèse, le transport de molécules, la transduction de signaux ou encore la motilité cellulaire. Des chercheurs du Laboratoire de chimie bactérienne (LCB, CNRS), du laboratoire de Bioénergétique et ingénierie des protéines (BIP, CNRS) et du Laboratoire de bioénergétique cellulaire (LBC, CEA) ont identifié, pour la première fois, le rôle précis du cardiolipide dans le processus d’activation d’un complexe membranaire respiratoire très courant chez la bactérie. Ce travail a été publié le 25 avril 2011 dans la revue PNAS.
Les progrès accomplis dans la résolution structurale de protéines membranaires ont permis d’y révéler la présence de lipides fortement associés et très souvent localisés en des sites bien spécifiques. La fixation de lipides confère à ces protéines une certaine stabilité structurale et peut contrôler leur repliement ou leur insertion à la membrane cellulaire. Dans le cas de complexes protéiques membranaires, tels que ceux ayant une fonction respiratoire, la fixation de lipides peut également être impliquée dans l’assemblage et même le fonctionnement de structures supramoléculaires, structures dites « supercomplexes ». La relation moléculaire entre la capacité d’un complexe respiratoire à fixer un lipide donné et son état d’activité n’avait cependant jamais été comprise.
En collaboration avec Pascal Arnoux du LBC et l’équipe de Bruno Guigliarelli au BIP, l’équipe d’Axel Magalon au LCB a étudié, chez la bactérie modèle Escherichia coli, les relations structurales et fonctionnelles qui existent entre les lipides et un complexe respiratoire largement répandu chez les organismes procaryotes, le complexe nitrate réductase. Ce complexe hétérotrimérique de 500 kDa est ancré sur la face cytoplasmique de la membrane interne et couple l’oxydation des quinols (*) à la réduction cytoplasmique du nitrate en nitrite via une chaîne de transfert d’électrons qui s’étend sur une longueur d’environ 100 Å et qui implique huit centres métalliques (deux hèmes de type « b », cinq centres fer-soufre et un cofacteur à molybdène).
Grâce à une approche multidisciplinaire, mêlant génétique, biochimie, analyse structurale et spectroscopie de résonance paramagnétique électronique (RPE), les chercheurs sont parvenus à définir, à un niveau moléculaire, le lien qui unit la fixation d’un lipide en particulier, le cardiolipide, à l’obtention d’un état fonctionnel du complexe nitrate réductase. La fixation de ce lipide anionique, minoritaire dans la cellule bactérienne, conduit à de subtils changements structuraux du complexe au voisinage de l’un des hèmes « b », lui permettant ainsi de fixer son substrat (le quinol) et d’utiliser ce dernier en tant que donneur d’électrons pour la réduction du nitrate. Le cardiolipide ayant la capacité de former des microdomaines dans la cellule bactérienne, les chercheurs ont émis l’hypothèse que la distribution des complexes respiratoires peut dépendre de leur liaison au lipide, ce qui peut, de fait, moduler leur mode de fonctionnement.
Cette étude est la première à montrer comment s’opère l’activation d’un complexe respiratoire par la fixation d’un lipide. La cardiolipide étant un composant clef du fonctionnement de la mitochondrie, véritable centrale énergétique de la cellule eucaryote, les chercheurs imaginent que la fixation de ce lipide aux complexes respiratoires mitochondriaux pourrait également être à l’origine d’une modulation de leur capacité à interagir avec les quinones.
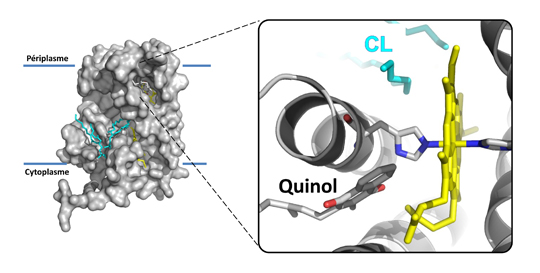
Figure : La fixation de cardiolipide (CL, en cyan) au voisinage d’un hème de type « b » (en jaune) permet la fixation du substrat, le quinol (en gris), et son utilisation, conduisant à l’activation du complexe nitrate réductase ancré dans la membrane cellulaire. © LCB, Axel Magalon
Note
- (*) Les quinols sont des molécules lipophiles qui transportent les électrons et les protons à travers les membranes. La réaction d’oxydation des quinols en quinones libère des électrons qui sont ici utilisés pour réduire le nitrate en nitrite.
En savoir plus
- Cardiolipin-based respiratory complex activation in bacteria, Rodrigo Arias-Cartin, Stéphane Grimaldi, Janine Pommier, Pascal Lanciano, Cédric Schaefer, Pascal Arnoux, Gérard Giordano, Bruno Guigliarelli, Axel Magalon, PNAS 108(19):7781-7786, Published ahead of print April 25, 2011, doi: 10.1073/pnas.1010427108.
Contact chercheurs