Nature |05 octobre 2016Â Â Â Â Â Â Â
The mechanism of force transmission at bacterial focal adhesion complexes
Laura M. Faure, Jean-Bernard Fiche, Leon Espinosa, Adrien Ducret, Vivek Anantharaman, Jennifer Luciano, SÃĐbastien Lhospice, Salim T. Islam, Julie TrÃĐguier, MÃĐlanie Sotes, Erkin Kuru, Michael S. Van Nieuwenhze, Yves V. Brun, Olivier ThÃĐodoly, Aravind L, Marcelo Nollmann & TÃĒm Mignot
Nature (2016) doi:10.1038/nature20121
Received 21 March 2016- Accepted 28 September 2016-Â Published online 05 October 2016
Abstract                               Â
Various rod-shaped bacteria mysteriously glide on surfaces in the absence of appendages such as flagella or pili. In the deltaproteobacterium Myxococcus xanthus, a putative gliding motility machinery (AglâGlt) localizes to so-called Focal Adhesion sites (FA) that form stationary contact points with the underlying surface. We discovered that the AglâGlt machinery contains an inner-membrane motor complex that moves intracellularly along a right-handed helical path, and when it becomes stationary at FA sites, it powers a left-handed rotation of the cell around its long axis. At FA sites, force transmission requires cyclic interactions between the molecular motor and adhesion proteins of the outer membrane via a periplasmic interaction platform, which presumably involves a contractile activity of motor components and possible interactions with the peptidoglycan. This work provides the first molecular model for bacterial gliding motility.
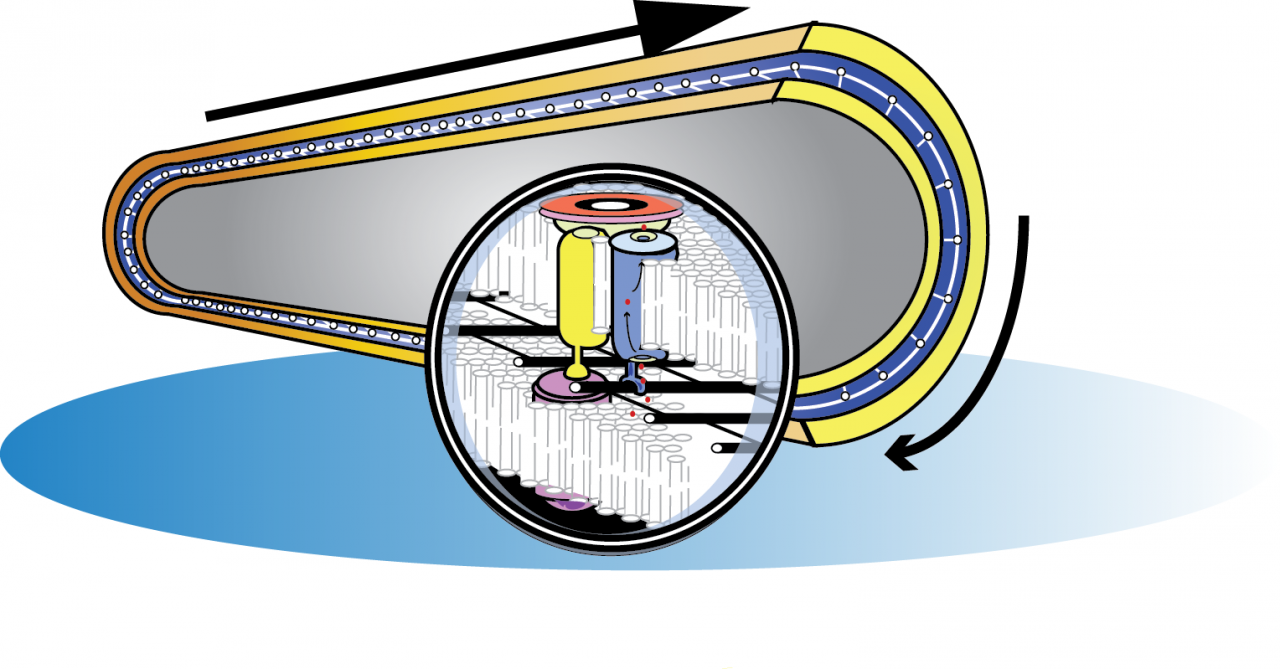
LÃĐgende de lâimage :
La motilitÃĐ de Myxococcus xanthus est propulsÃĐe par lâaction rotative de complexes dâadhÃĐsion focale qui se dÃĐplacent hÃĐlicoÃŊdalement dans la membrane interne. Lâinteraction avec la surface est ÃĐtablit par des contacts cycliques entre le complexe de membrane interne (jaune) et le complexe adhÃĐsif de membrane externe (rose) à travers le paroi bactÃĐrienne (noir). Ces contacts sont ÃĐnergisÃĐs par un moteur molÃĐculaire (bleu) de type canal à protons (points rouges). Dans le cytosol le complexe de motilitÃĐ est connectÃĐ Ã un ÃĐchafaudage dâactine bactÃĐrienne (rouge).