Le déplacement des cellules bactériennes est essentiel pour la recherche d’un nouvel environnement, la prédation et l’interaction avec l’hôte lors de cycles infectieux. Dans cette étude publiée dans la revue Embo Journal, les scientifiques ont décrypté le mécanisme moléculaire qui permet d’activer l’appareil de motilité au pôle de la bactérie sociale Myxococcus xanthus. Ces travaux permettent de mieux comprendre les mécanismes qui régulent spatialement les machineries moléculaires participant au déplacement coordonné de milliers de bactéries sur des surfaces.
Les bactéries possèdent un arsenal diversifié d’appendices extracellulaires essentiels pour leur survie dans l’environnement, l’interaction avec leur hôte lors de cycle infectieux mais aussi la création de communautés bactériennes complexes. Chez les bactéries en forme de bâtonnet, les pili (longs filaments protéiques dynamiques) de type IV favorisent la motilité en s'assemblant et en se rétractant au pôle cellulaire. Ils sont généralement présents aux deux pôles de la cellule mais seulement actifs à un seul. Chez Myxococcus xanthus, bactérie se déplaçant en groupes cellulaires hautement coordonnés, les pili sont activés par une protéine polaire, SgmX. Pourtant, bien que l'on sache que la petite GTPase MglA est nécessaire pour le ciblage unipolaire de SgmX, comment cette dernière est-elle recrutée au pôle cellulaire pour activer les pili ?
Dans ce travail, les scientifiques démontrent que la localisation polaire de SgmX dépend d’une protéine FrzS, qui agit comme une ancre au pôle de la cellule. La dissection moléculaire de la protéine FrzS a révélé qu’un domaine receveur (CheY) atypique interagit directement avec SgmX. Ces domaines sont généralement phosphorylés, mais ce n’est pas le cas pour le domaine CheY de FrzS pour laquelle une analyse par spectroscopie RMN révèle une nouvelle interface d’interaction pour un régulateur de réponse. Ainsi le domaine CheY de FrzS définit une nouvelle classe de domaines impliqués dans les interactions protéine-protéine.
Ces travaux mettent au jour comment un complexe tri-protéique (ici formé de SgmX, MglA et FrzS) peut réguler l’activation asymétrique de machineries moléculaires responsables de la motilité coordonnée de groupes de cellules. De plus, ces travaux ouvrent des perspectives sur la compréhension du mode d’action des régulateurs de réponse atypiques, famille de régulateurs largement représentés dans le monde bactérien mais dont les fonctions sont encore mal comprises.
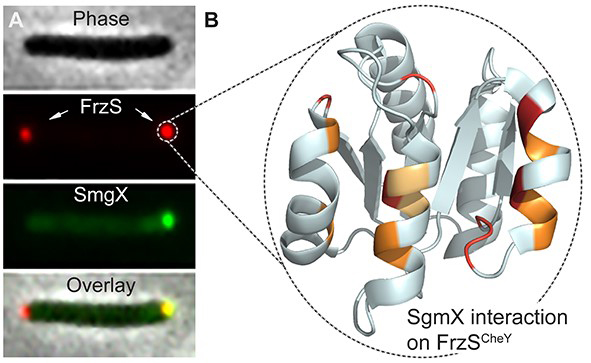
Figure : A) Localisation intracellulaire des protéines FrzS (Rouge) et SgmX (Vert).
B) Structure cristalline du domaine CheY de la protéine FrzS représentant les acides aminés en rouge et orange impliqués dans l’interaction avec la protéine SgmX
Pour en savoir plus :
FrzS acts as a polar beacon to recruit SgmX, a central activator of type IV pili during Myxococcus xanthus motility.
Sarah Bautista, Victoria Schmidt, Annick Guiseppi, Emillia M. F Mauriello, Bouchra Attia, Latifa Elantak, Tâm Mignot and Romain Mercier.
The EMBO Journal, november 2022 https://doi.org/10.15252/embj.2022111661
Contact
Laboratoire
Laboratoire de chimie bactérienne - LCB (CNRS/Université d’Aix-Marseille)
31 Chemin Joseph Aiguier
13402 Marseille Cedex 20